Tartu Ülikooli tehnoloogiainstituudi teadlaste rühm tegi rakkude pooldumist uurides ajakirjas Nature avaldamist väärt avastuse, astudes sammu edasi lülitite disainimisel uues teadusharus – sünteetilises bioloogias.

Tartu Ülikooli tehnoloogiainstituudi teadlaste rühm tegi rakkude pooldumist uurides ajakirjas Nature avaldamist väärt avastuse, astudes sammu edasi lülitite disainimisel uues teadusharus – sünteetilises bioloogias.
Tehnoloogiainstituudi direktor Erik Puura tõdes, et Nature'isse kui kõiki teadusvaldkondi haaravasse väljaandesse jõudmine on alati eriline sündmus. Molekulaarbioloogia vanemteaduri Mart Loogi juhitud uurimisrühma saavutuse teeb eriti tähelepanuväärseks see, et kõik rühma liikmed on eestlased.
«Minu teada on see esimene Nature'i artikkel, mille taga on täielikult Eesti kollektiiv,» lausus Puura.
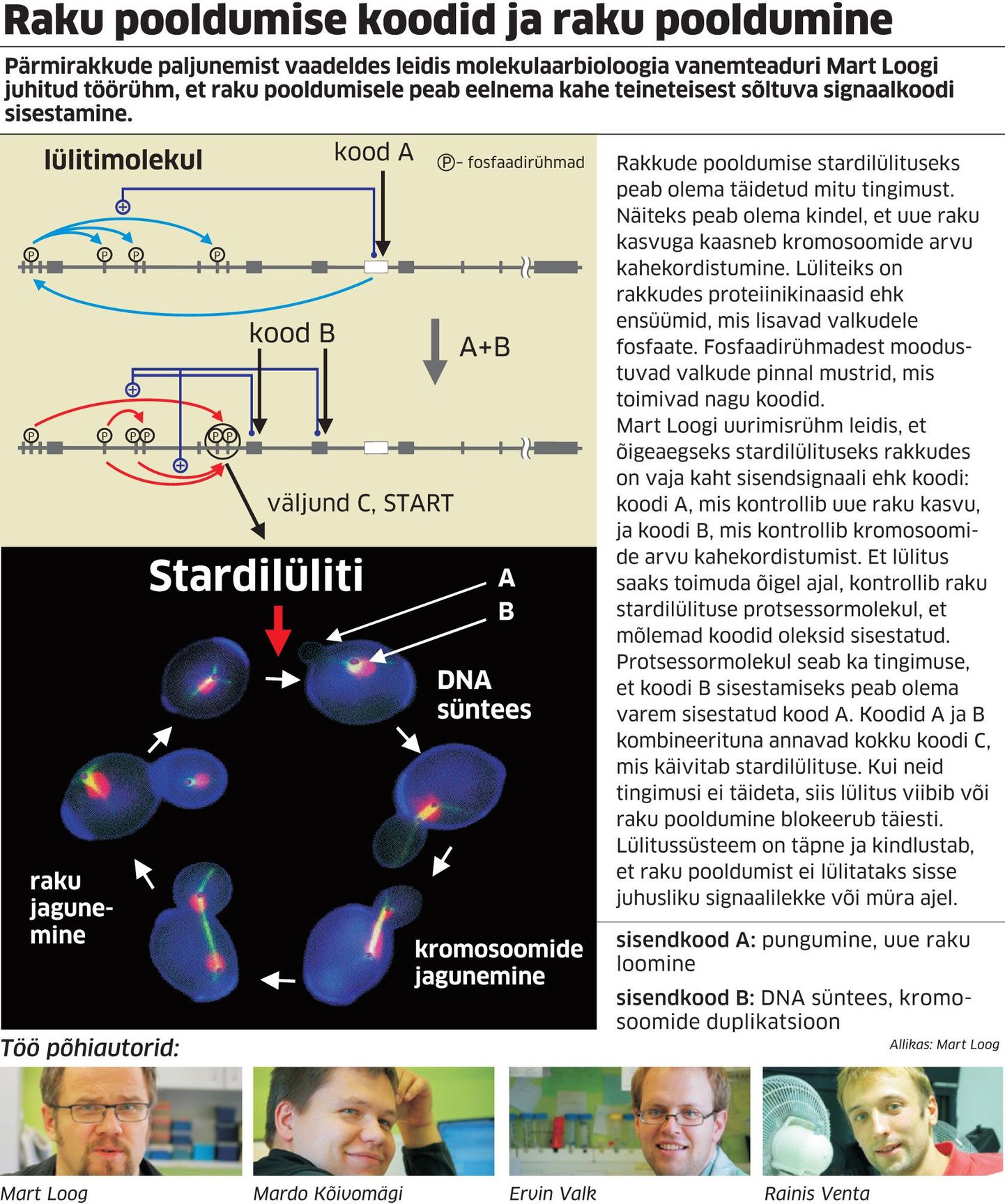
Pärmirakkude paljunemist vaadeldes leidis molekulaarbioloogia vanemteaduri Mart Loogi juhitud uurimisrühm, et raku pooldumisele peab eelnema kahe teineteisest sõltuva signaalkoodi sisestamine. Koodiks on valkude pinnal olevad mustrid, mis moodustuvad fosfaadirühmadest.
Poekassa analoogia
Et raku pooldumine algaks, peavad proteiinikinaasid ehk rakusiseste lülititena toimivad ensüümid lisama valkudele fosfaadirühmi. Kinaasid loevad protsessoralasid valgu pinnal ja lisavad sinna kindla koodi. See kood või mitme koodi summa annab käsu lülituseks. Teadlased võrdlevad nähtust piltlikult ribakoodi lugemisega kauplusekassas.
Alles siis, kui kinaasid on edukalt lugenud mõlemad signaalkoodid ehk kassaaparaat kauba ära tundnud, annab ensüüm stardikäsu ning järgneb raku pooldumine.
«Selline evolutsioonis väljakujunenud keeruline lahendus võib inspireerida insenerimõtlemist ja kirjeldatud printsiipi saab rakendada sünteetilises bioloogias, mille eesmärk on luua ravimeid ning biokütuseid kunstlikes rakkudes,» usub Mart Loog.
Loog tõdeb, et otsest praktilist väljundit mitmeaastasele tööle järgnenud avastusele pole praegu võimalik pakkuda. Loog on küll nõus tooma oma rühma avastuse sisu paremaks mõistmiseks just seose vähkkasvajaga: vähirakud hakkavad kontrollimatult vohama, sest geenimutatsiooni või -mutatsioonide tõttu on raku pooldumist või pooldumise vältimist kontrolliv stardilüliti korrast ära.
«Kuid multifosforüleerimise koodi tundes võib luua molekulaarseid signaaliprotsessoreid ja lüliteid vastavalt olukorra vajadusele,» räägib Loog. «Nii saab paremini juhtida kunstlikult kokku pandud mikroorganisme, mis suudavad toota näiteks biokütuseid või ravimeid.»
Mart Loog selgitab, et nagu iga huviline võib osta poest erinevaid takisteid, kondensaatoreid ning muid juppe, et panna põlve otsas kokku raadio või kitarrivõimendi, võib juba lähemas tulevikus olla võimalik analoogia sünteetilise bioloogia valdkonnas.
Näiteks võib niimoodi programmeerida ja reguleerida kunstlikult kokku pandud ja paljude ensüümide abil katalüüsitavat biosünteesi masinavärki, vältides soovitava aine tootmise vaheetappides ummistusi.
Proteiinikinaaside kohta ja valkude pinnal olevate fosfaadimustrite ehk multifosfo-
rüleerimise koodi kohta avaldatud Nature'i artikli esimene autor on doktorant Mardo Kõivomägi. Talle aitasid kaasa peamiselt doktorandid Ervin Valk ning Rainis Venta.
Miljardeid uurimisele
Mart Loogi hinnangul on tehnoloogiainstituudi noorte teadlaste avastuse väärtus seda suurem, et proteiinikinaasidele suunatud ravimiarendus on väldanud intensiivselt juba aastakümneid ning sellele on ravimitööstus kulutanud kümneid miljardeid eurosid.
Uurimistööd rahastas Londonis asuv fond Wellcome Trust.